解密 | 君实生物特瑞普利单抗研究何以入选ASCO全体大会
该文来源于 研发客:毛冬蕾
带有“东方”临床需求的JUPITER-02研究入选ASCO大会“重磅研究摘要”(LBA),体现出中国肿瘤领域在全球学术地位的提升。与此同时,ASCO也拥抱亚洲病患,凸显其为全球肿瘤患者提供最优质与平等癌症护理的理念。
“鼻咽癌是一种侵袭性强的恶性肿瘤,特别是对复发/转移性鼻咽癌患者,治疗手段极其有限。而特瑞普利单抗的临床结果显示,这些患者有望拥有新的治疗选择。”
北京时间6月7日凌晨1点半,中山大学肿瘤防治中心院长徐瑞华教授从广州连线全球,向参与美国临床肿瘤学会(ASCO)年会全体大会的各国专家,在线介绍了PD-1抑制剂特瑞普利单抗联合化疗一线治疗复发/转移性鼻咽癌的全球多中心、随机、双盲、安慰剂对照III期临床研究(JUPITER-02)的结果。
一位中国主要研究者登上ASCO主会场
每年6月举办的ASCO年会素有国际肿瘤学“奥斯卡盛典”之称,聚集了世界各地的一流肿瘤专家一起分享最新肿瘤领域学术成果。
今年,一项记录被打破——ASCO年会的“主会场”plenary session迎来了首个中国研究,一项由中国研究者主导、应用本土创新药、针对国人高发肿瘤开展的JUPITER-02研究。

徐瑞华教授在2021年ASCO年会plenary session上发言
ASCO从上万份年会投稿中评选出5篇“重磅研究摘要”(Late-breaking Abstract,LBA),由研究者在全体大会环节做主题发言。带有“东方”特色的JUPITER-02研究入选LBA,对此,业界评价认为,这从侧面体现出近年来中国肿瘤领域在全球学术地位的上升。
“与其他癌种相比,晚期鼻咽癌的治疗已处于落后地位,但JUPITER-02研究结果为患者带来了新的改善疗效的希望,也将改变我们对鼻咽癌的治疗方式。”ASCO首席医学官Julie R. Gralow博士表示。
“入选LBA对我和我的团队是极高荣誉,也对致力于治疗鼻咽癌患者的肿瘤学家给予了鼓励。”尽管徐瑞华教授曾在国内外多个学术场合发表过演讲,但这一次,面对线上会场的小小屏幕,他仍显得略微激动。
徐瑞华的脑海里浮现出一幅幅来自广东鼻咽癌患者的画面,那是一些遭受了巨大痛苦的患者。“许多入组病人的鼻腔部经过反复手术已完全毁容变形,有些肿瘤长大后入侵眼部、脑骨,甚至造成压迫性失明。”
对他来说,JUPITER-02研究的分量很沉,因为承载着太多因罹患鼻咽癌遭受着身心折磨的患者的期待。
患者在参加临床试验治疗几个周期之后,眼部和鼻腔的肿瘤消失了,病情得到了好转。尽管徐瑞华教授在肿瘤科临床工作中经历了许多生与死,但每当看到这样的变化,他的内心仍然深受鼓舞。
同样内心受到触动的,还有参与研发的君实生物高级副总裁姚盛博士。他在接受研发客的专访时说,2011年以来,中国创新药物的研究成果入选ASCO大会这样的国际会议已越来越多,从原来只有摘要、壁报展示,到有口头报告,再到现在首次入选LBA,一方面说明中国肿瘤治疗领域的学术水平正在不断提升,受到了国际认可,另一方面则代表中国药物的研发不再处于单纯的模仿阶段,而是做到了独特的创新。
这也是姚盛博士第二次以非常科普的方式,讲解一个复杂而又系统的临床试验过程。
为何选择晚期鼻咽癌
2015年,特瑞普利单抗作为中国首个国产PD-1抑制剂获得国家药监局批准进入临床试验。“当时全球第一款PD-1抑制剂已经上市1年,我们希望后来者居上。”姚盛说。
君实生物挑选的第一个适应症是黑色素瘤。黑色素瘤因具有明显的肿瘤相关抗原,非常适合免疫治疗,被称为免疫治疗的“试金石”,海外的O药、K药等免疫治疗药物都是从这个瘤种开始做临床验证。如果说选择黑色素瘤还有迹可循,那么第二个适应症为何会选择鼻咽癌,就让人非常困惑,毕竟对于免疫治疗来说,这个领域一片空白。
是什么原因让君实生物下定决心去研究这一方向?其背后的故事体现出的是研究者、研发团队对患者和临床实践的洞察,应用转化医学手段精准锁定药物适用人群的智慧,还有不断深耕开展大样本研究的坚持。
徐瑞华教授向与会者介绍说,鼻咽癌是一种发生于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部恶性肿瘤之一。据统计,2020年全球确诊鼻咽癌新发病例数超过13万,近半数发生在中国,尤其是南方地区(如广东、广西等),其余约30%发生在东南亚地区。
铂类治疗是复发或转移性鼻咽癌的标准一线治疗,但患者治疗后,中位无进展生存只有7个月左右,一旦进展,二线开始无标准治疗,中位总生存期在一年左右。
“这是临床需求急需被满足的领域,但由于发病区域相对集中,海外特别是欧美国家并不重视这个瘤种的药物研发,亚洲患者长期处于无药可用的状态,我们要靠自己的力量改变这一现状。”徐瑞华教授说。
据姚盛博士回忆,君实生物针对特瑞普利单抗制定的临床开发策略非常关注亚洲人群的高发瘤种。2016年时,跨国药厂更倾向研究肺癌、皮肤癌等西方高发病种,而国人中高发的胃癌、食管癌、肝癌的药物临床研究则刚刚起步。
徐瑞华教授在国内胃肠道等领域的研究造诣很深,很自然的,君实生物把一项探索多种实体瘤的Ib/II期探索性研究放在了具有丰富创新药经验的中山大学肿瘤防治中心。
由于不限癌种,除了纳入胃癌、食管癌、胆管癌等消化道瘤种,研究还同时入组了在广州患者基数较大的鼻咽癌患者。当时,全球范围内还未有任何关于鼻咽癌的免疫治疗数据发表。
从事实验室新药开发和转化医学工作多年的姚盛作为公司研发决策者之一,在试验过程中,组织开展了大量分子标志物(biomarker)分析。
结果出来后,研发人员惊喜地看到,鼻咽癌组织PD-L1表达水平极高,同时含有大量浸润淋巴细胞。此外,以往也有研究观察到与鼻咽癌密切相关的EB病毒(EBV)可诱导癌细胞表达高水平PD-L1。这些都在提示,鼻咽癌是一种病毒诱导的,拥有较强免疫原性,可能适合免疫治疗的瘤种。
而临床上的表现也印证了这一推测。2016年3月,首例患者入组。仅接受了两三次给药,一些鼻咽癌患者就显示出了明显疗果,肿瘤不断缩小。这也促使君实生物下定决心于2016年9月启动了一项免疫单药二线及后线治疗的II期单臂临床试验(POLARIS-02研究)。
随着积极的结果在更大的样本中得到验证,2018年7月,一线治疗鼻咽癌的III期JUPITER-02研究注册启动。
君实生物随即在全球率先布局鼻咽癌新药临床研究。回想起立项时的“冒险”经历,姚盛说,新药的适应症开发往往充满挑战,如何将风险变成机遇,就需要前期有大量的生物标记物研究和转化医学研究,帮助你寻找合适的瘤种和适用人群,奠定大样本研究成功的基础。
此外,Ib/II期采用的“篮子试验”方案也非常关键。“篮子试验设计让我们在早期没有数据参考和对照药的情况下,针对多个瘤种完成了单药和联合疗法不同剂量的安全疗效探索。”姚盛说。
PD-1抑制剂与化疗联合,其最大风险是化疗对免疫细胞的杀伤,最后是否能达到增效效果,一开始其实是未知的。
“只有早期临床试验工作做踏实了,才能有的放矢为后期研究做好铺垫。”姚盛说。
JUPITER-02研究数据
接下来的工作则一马平川。在讲解中,姚盛博士给出特瑞普利单抗鼻咽癌系列研究的重大事件表(见下图)。“所有这些工作,都离不开审评机构的老师、研究者、患者的积极参与和奉献及团队强有力、高质量的执行。”

姚盛博士告诉研发客,“全线贯穿”是指对不同阶段的鼻咽癌的临床治疗都覆盖,包括局部晚期、复发、一线系统治疗和二/三线的系统治疗。
目前特瑞普利单抗已在三线实现上市,在二线启动美国BLA申报,在一线完成了III期和中国NDA申报,现正在推进局部晚期鼻咽癌的新辅助/辅助临床试验。
根据徐瑞华教授的主题报告,从2018年11月到2019年10月,JUPITER-02研究者从中国大陆、中国台湾和新加坡的35个临床研究中心筛选了408名患者,最终入组289名既往未接受过化疗的复发/转移性鼻咽癌患者,按随机1:1进入特瑞普利单抗联合化疗组(146例)或安慰剂联合化疗组(143例)。治疗组每三周接受一次240mg特瑞普利单抗+吉西他滨+顺铂(GP化疗),然后接受特瑞普利单抗作为维持治疗;对照组接受6周安慰剂+GP化疗,然后接受安慰剂作为维持治疗。
该研究的主要终点是独立评审委员会(BIRC)的所有研究患者的疾病无进展生存期(PFS),次要终点包括研究者评估的疾病无进展生存期(PFS),客观缓解率(ORR)、缓解持续时间(DOR)和总生存期(OS)。

在选择JUPITER-02研究的主要终点时,君实生物选择了PFS,而非OS。姚盛说,考虑到适应症的需求迫切性,公司在申报临床前同时与中国和美国药监部门进行沟通交流,虽然是分开讨论,但两方在决策上却意外的一致,都同意用PFS作为主要临床终点,同时要求OS没有负向作用。一线治疗整体OS往往长达29个月,如果以OS作为主要终点,试验随访期将增加,数据量要求大,并不有利于具有潜在临床价值的新药快速上市。
“这让我们看到中国加入ICH后,审评标准和能力都已和国际接轨。”姚盛说。
主要终点PFS由设盲的BIRC进行评估。2020年9月,BIRC判定主要研究终点达到方案预设的优效界值,建议提早揭盲。结果表明,与单纯化疗相比,特瑞普利单抗联合化疗的一线治疗可显著延长复发或转移性鼻咽癌患者的PFS,中位PFS为11.7 vs. 8.0个月(HR=0.52 [95%CI:0.36-0.74],p=0.0003)。将近一半(49%)患者超过一年还没有发生疾病进展,大幅延长了病人的无进展生存时间。
而盲态研究者的评估结果更为出色,HR=0.41 [95%CI:0.28-0.59],p < 0.0001,即降低了59%的疾病进展和死亡风险,P值更加显著。中位PFS的优势也更明显,其中,安慰剂组的中位PFS仍为8.0个月,但特瑞普利单抗组的中位PFS还未达到,目前已随访超过18个月。
“相较BIRC的评估方式,研究者的评估依据更加丰富,除了影像数据,还需要做内窥镜来判断局部是否会复发,因此数据上会有差异。”姚盛认为,患者的处理和维护都由研究者根据疾病进展情况来决定,因此盲态研究者数据更能够体现出患者经过研究者临床管理(clinical management)后所反应的实际操作情况。
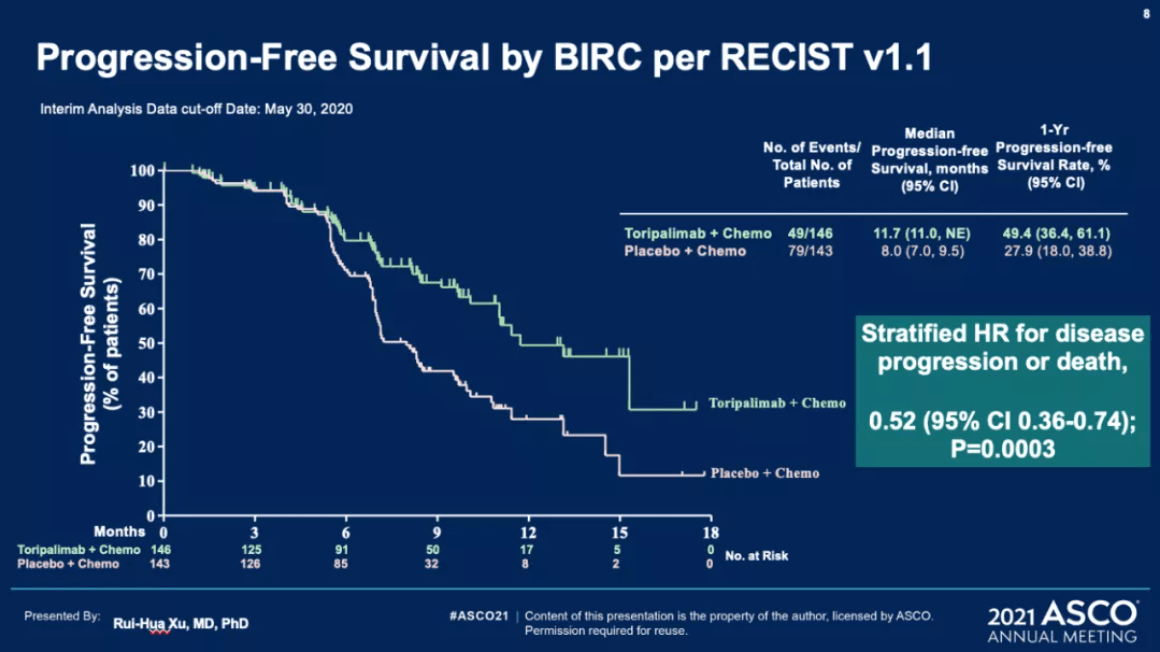
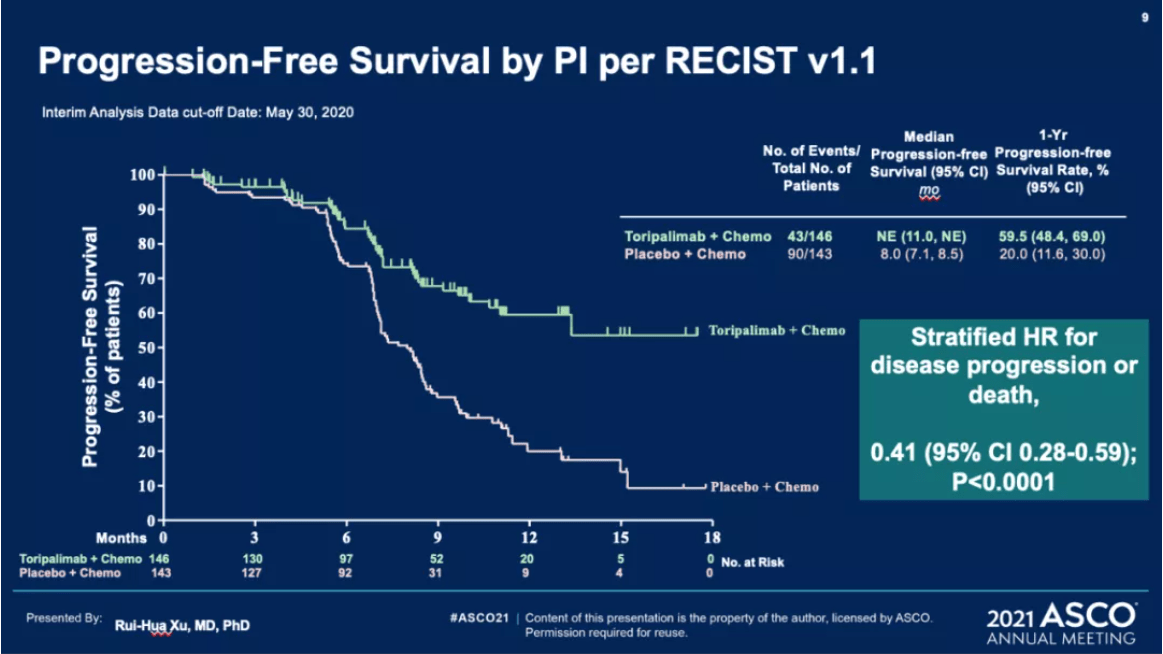
BIRC(上)与研究者(下)判定的PFS(图片来自徐瑞华教授的PPT)
在OS方面,研究者在揭盲后每三个月对患者进行一次生存期随访。今年5月,也就是期中分析后9个月,尽管特瑞普利单抗组和安慰剂组的中位OS均未成熟,但可以观察到两组OS曲线开始分离,出现获益趋势,且特瑞普利单抗组的死亡风险比安慰剂组降低了40%,HR为0.603,P值为0.0462,差异显著。
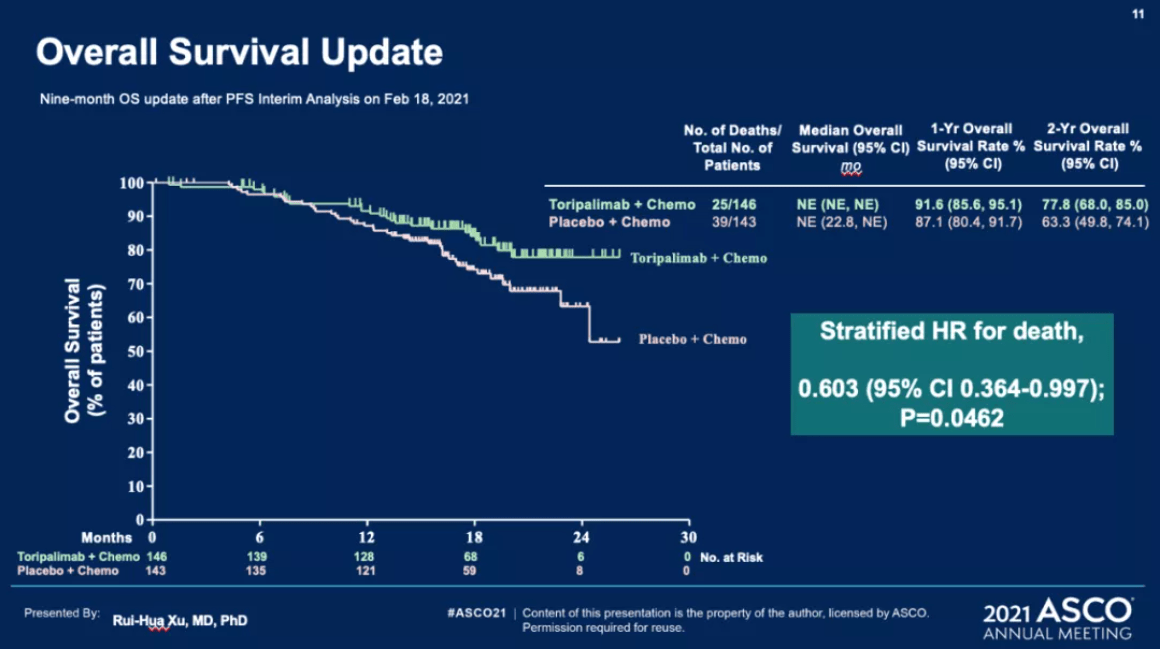
期中分析后9个月观察到的OS(图片来自徐瑞华教授的PPT)
随着国家药品监督管理局对药物警戒的重视,临床研究中不良事件的发生也被重点关注。在徐瑞华教授的介绍中,两组的3级及以上不良事件(AE)的发生率相似(89.0%vs. 89.5%)。特瑞普利单抗组的免疫相关AE(39.7% vs. 18.9%)和3级及以上免疫相关AE(7.5% vs. 0.7%)更常见,这一结果与特瑞普利单抗的机理有关。
作为一种免疫检查点抑制剂,特瑞普利单抗的作用是阻断免疫细胞表面上的程序性死亡因子1(PD-1)与肿瘤细胞表面表达的PD-L1(PD-1配体)之间的“休眠”通路,从而激活免疫系统来对抗肿瘤。但免疫相关AE在临床观察和治疗中一般都是可控的。
今年2月,基于JUPITER-02研究的结果,国家药监局已受理特瑞普利单抗联合化疗用于晚期一线未接受过系统性治疗的复发/转移性鼻咽癌的新适应症上市申请。同月,基于POLARIS-02研究,特瑞普利单抗获得国家药品监督管理局批准,用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗,成为全球首个获批鼻咽癌治疗的抗PD-1单抗。
“毫不夸张地说,特瑞普利单抗实现了鼻咽癌领域内免疫治疗零的突破。期待它在这个领域的继续深耕,为中国乃至全球患者带来更多创新的治疗方案和更长的生存获益。”徐瑞华说。
深耕本土未满足临床需求
今年3月,君实生物宣布已开始向美国FDA滚动提交特瑞普利单抗用于治疗复发或转移性鼻咽癌的生物制品许可申请(BLA)。“我们管线上自主研发的核心产品都走的是中美双报策略。”姚盛说,2020年,特瑞普利单抗用于治疗复发/转移性鼻咽癌相继获得美国FDA的孤儿药资格和突破性疗法认定,成为首个获得FDA突破性疗法认定的国产PD-1抑制剂。
基于突破性疗法,君实生物可向FDA滚动提交上市申请并获得滚动审评,将大幅缩短新药的审评周期。姚盛认为,对于具有创新性的适应症和疗法,中美双报的机会更多。
今年的ASCO年会,特瑞普利单抗的研究发表数量也刷新了记录,共入选39项,除了JUPITER-02研究获得的全体大会LBA,还有1项专场口头报告、15项壁报展示和若干线上摘要,覆盖鼻咽癌、黑色素瘤、肺癌、胃癌、食管癌、肝癌、胆管癌、头颈癌、胰腺癌等十多个瘤种。
其中,多达10项的特瑞普利单抗辅助/新辅助/围手术期治疗非小细胞肺癌、食管癌、胃癌、黏膜黑色素瘤等领域的II期研究集中亮相。总的来看,特瑞普利单抗的研发策略也在紧随现在全球免疫治疗的最新趋势——从后线往一线推,再到新辅助/辅助/围手术期治疗。
“免疫治疗最大的优势是全线贯通,早期病人转移病灶较少的情况下,免疫治疗可能会更加有效。”姚盛说。
作为“立足中国”的创新药企,下一步,特瑞普利单抗的开发重心将继续放在胃、食管、肝胆肿瘤,这些方向也代表了目前本土尚待满足的临床需求。
鼻咽癌新药研发一路走过来,姚盛博士感悟颇深:“做跟随者,重复一个试验,可能也会获批,但患者的境遇不会有根本上的改变,但如果开创了一个新的治疗方法,一旦成功,将会为这类患者带来巨大的社会获益,这是我们制药人最希望看到的结果。”
而徐瑞华教授,皆因特瑞普利单抗这一新药面世,解除了鼻咽癌患者的疾苦,他表示内心的不安与难过也得到了深深的舒缓,并由衷的感到高兴。
来源;搜狐网
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
